In Deutschland sind ca. 1,4 Millionen Erwachsene von unerfülltem Kinderwunsch über einen Zeitraum von mehr als einem Jahr betroffen. In den westlichen Industrienationen hat der Anteil – etwa 15% – ungewollt kinderloser Paare im reproduktionsfähigen Alter in den letzten Jahren stetig zugenommen. Nach Schätzungen der WHO verteilen sich die Sterilitätsursachen mit 30-40% etwa zu gleichen Teilen auf Männer und Frauen. In ca. 20% liegen Ursachen bei beiden Partnern vor. Bei 10-15 % der betroffenen Paare bleibt die Ursache ungeklärt. (1)
Neben einer gynäkologischen, endokrinologischen und andrologischen Abklärung ist meist auch eine genetische Untersuchung beider Partner indiziert. (2)
Eine der Hauptursachen für weibliche Infertilität sind hormonelle Störungen, die durch erhöhte Androgenwerte in Verbindung mit Ovarialzysten, Gewichtsproblemen, starken körperlichen Belastungen oder Störungen der Schilddrüsenfunktion hervorgerufen werden. Seltener sind Tumore oder bestimmte Medikamente ursächlich für Hormonstörungen. Etwa 1/3 der infertilen Frauen weisen teilweise oder komplette Verschlüsse der Eileiter auf, deutlich seltener sind Fehlbildungen der inneren Geschlechtsorgane. Vergleichsweise häufig ist die Bildung von Antikörpern gegen männliches Sperma.
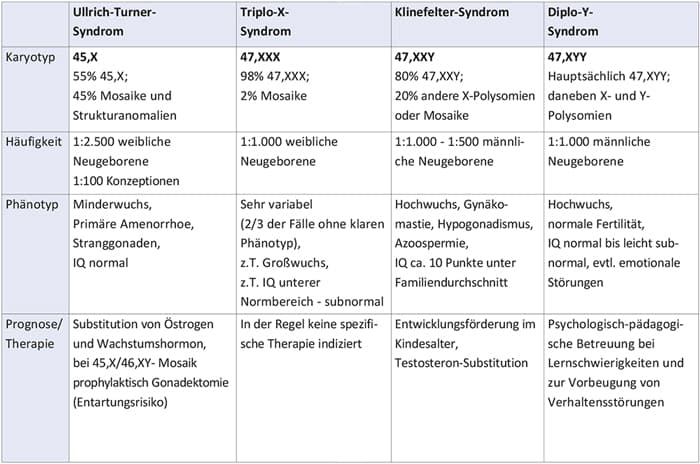
Zu den häufigsten chromosomalenUrsachenweiblicherFertilitätsstörungen gehören:
- Ullrich-Turner-Syndrom (primäre Ovarialinsuffizienz, Kleinwuchs)
- Triplo-X-Syndrom (z.T. Ovarialinsuffizienz / Climacterium praecox)
- gonosomale Mosaike (ca. 0,7% der Fälle)
- reziproke Translokationen (ca. 1% der Fälle)
- Robertsonsche Translokationen (ca. 0,4% der Fälle)
Die häufigste Ursache männlicher Infertilität liegt in der unzureichenden Produktion normaler, gut motiler Spermien. Erst ab einer Spermienzahl von 20 Mio/ml Sperma mit 30% morphologisch normalen und 50% gut beweglichen Spermien geht man von einer gesicherten Zeugungsfähigkeit aus. Störungen der Spermienreifung können beispielsweise durch eine Parotitisepidemica, Varicocele, Infektionen, Hormonstörungen, Umweltbelastungen, Hodenhochstand oder Chemotherapie nach Tumorerkrankungen bedingt sein. Etwa 4% der infertilen Männer weisen Verschlüsse der Samenleiter auf. Chromosomale Veränderungen sind bei ca. 2% der infertilen Männer, d.h. ca. 10mal häufiger zu finden als in der männlichen Allgemeinbevölkerung. Zu den häufigsten chromosomalen Ursachen männlicher Infertilität (3) gehören:
- numerische, gonosomale Aberrationen (z. B. Klinefelter-Syndrom, ca. 5% der Fälle)
- gonosomale Mosaike (ca. 0,5% der Fälle)
- reziproke Translokationen (ca. 1% der Fälle)
- Robertsonsche Translokationen (ca. 0,6% der Fälle)
Die Wahrscheinlichkeit für eine Chromosomenanomalie steigt hierbei mit der Abnahme der Spermienzahl. Während die Rate von Chromosomenanomalien bei Neugeborenen ca. 0,6% beträgt, liegt sie bei Männern mit Azoospermie bei 13-15%, während sie bei Männern mit Oligozoospermie (<10 Millionen Spermien/ml) bei 7-10% liegt.
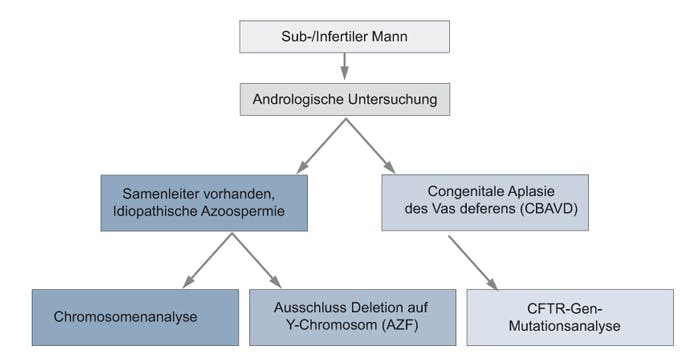
Etwa 0,6-1% der infertilen Patienten weisen Deletionen im langen Arm des Y-Chromosoms (Yq11) auf (Azoospermiefaktor, AZF). Die Prävalenz von AZF-Deletionen beträgt bei Patienten mit einer nicht-obstruktiven Azoospermie 15% und etwa 7% bei Männern mit schwerer Oligozoospermie (<1 Mio. Spermien/ml Ejakulat). In der AZF-Region sind Gene lokalisiert, die für die Spermiogenese unentbehrlich sind. Bei Deletionen findet man in der Testis-Histologie einen testikulärenMaturationsarrest oder unreife,kondensierteSpermien. Der Deletionsnachweis erfolgt mittels PCR von sechs Y-chromosomalen Markern aus den Regionen AZFa, AZFb und AZFc.
Eine Azoospermie kann auch durch Obstruktion der Samenleiter bedingt sein. Sind keine Samenleiter angelegt (Congenitale bilaterale Aplasie des Vas deferens, CBAVD), liegen häufig pathogene Varianten im CFTR-Gen vor. Homozygote bzw. compound hetrozygote Varianten im CFTR-Gen sind daneben verantwortlich für Cystische Fibrose. Allerdings findet man bei CBAVD andere Kombinationen von varianten Allelen als bei CF. Charakteristisch für CBAVD sind Kombinationen aus einer „schweren“ (z. B. F508del) und einer „milden“ Variante (z. B. R117H) oder zwei „milde“ Variantren. Falls nur eine Variante nachweisbar ist, muss dennoch von einer zweiten, mit der derzeitigen Diagnostik nicht nachweisbaren Variante ausgegangen werden. Vor einer geplanten künstlichen Befruchtung (ICSI) sollte deshalb auch die Partnerin eines CFTR-Anlageträgers auf Varianten im CFTR-Gen untersucht werden. Darüber hinaus sind geschlechtsabhängig zahlreiche seltenere genetische Ursachen einer Infertilität beschrieben, wie z. B. Adrenogenitales Syndrom (CYP21A2-Gen), Androgeninsensitivitätssyndrom (AR-Gen), FSH-Rezeptor-Defizienz (FSHR-Gen) oder 46,XY-DSD (SRY-Gen).
- Ungewollt kinderlos, Berlin-Institut für Bevölkerung und Entwicklung 2007, www.berlin-institut.org
- Genetische Diagnostik bei ungewollter Kinderlosigkeit, Wegener & Bloechle Gynäkol Geburtsmed Gynäkol Endokriol 5:168-181 (2009)
- Genetik der männlichen Infertilität, Tüttelmann et al Urologe 47:1561-1567 (2008)

