QM-System
Als medizinisches Laboratorium steht für uns an der MVZ Martinsried GmbH die Patientensicherheit an erster Stelle. Deshalb arbeiten wir nach hohen Qualitätsstandards und sind seit etwa 20 Jahren nach DIN EN ISO 15189 „Medizinische Laboratorien – Besondere Anforderungen an die Qualität und Kompetenz“ akkreditiert. Dadurch wird nicht nur das Vorliegen eines umfassenden Qualitätsmanagement-Systems, sondern vor allem die fachliche Kompetenz aller Mitarbeitenden bestätigt.
Unser Labor strebt stets den neuesten Stand der Technik an und erweitert fortlaufend den Akkreditierungsbereich. So konnte 2013 die Akkreditierung der Next Generation Sequencing Methode erreicht werden. Seit 2018 sind wir für die CNV-Detektion mittels NGS akkreditiert und seit 2019 für den nicht invasiven Pränataltest VERACITY.
Zusätzlich zu der Patientenversorgung übernimmt das MVZ Martinsried Analyseaufträge, die unter die GMP- und GCP-Richtlinien fallen. Die besonderen Anforderungen aus den GMP- und GCP- Leitlinien sind in unserem Qualitätsmanagement umgesetzt und werden durch regelmäßige Inspektionen von Behörden und Auftraggebern kontrolliert.
Das Qualitätsmanagement-System wird laufend weiterentwickelt und den notwendigen Normen und Regelwerken angepasst, sodass zukünftige Herausforderungen gemeistert werden und die Qualität der medizinischen Versorgung stets auf höchstem Niveau bleibt.
Aufgaben
- Ausführliche Dokumentation aller Labor-relevanten Prozesse im eigenen Dokumentenlenkungssystem
- Ausschließlicher Einsatz geeigneter analytischer Methoden (Validierung)
- Regelmäßige Teilnahme an externen Qualitätssicherungsprogrammen (Ringversuchen)
- Durchführen interner Qualitätskontrollen
- Intensive Fort- und Weiterbildung aller Labormitarbeiter
- Räumliche und technische Ausstattung nach dem neuesten Stand der Technik
- Überwachung der analytischen Geräte (Wartung, Kalibrierung, Qualifizierung)
- Prüfung der Maßnahmen zur Qualitätssicherung durch interne Audits
Akkreditierte und zertifizierte Bereiche
Richtlinie / Norm | Abteilung / Bereich | Stelle / Behörde | Stand | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| DIN EN ISO 15189 | alle Laborabteilungen | Deutsche Akkreditierungsstelle GmbH | Reakkreditierung gültig seit 21.10.2019 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| GMP Leitfaden der Europäischen Gemeinschaft | HLA-Typisierung | Regierung von Oberbayern | gültig seit 17.09.2024 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EFI Standards for histocompatibility testing | HLA-Typisierung, Chimärismusanalysen | European Federation for Immunogenetics (EFI) | gültig bis 12/2024 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ringversuche, Urkunden & Zertifikate
IVDR
Beschwerdemanagement
Im Beschwerdemanagement befassen wir uns mit dem Feedback unserer Einsender und Patienten zu unseren Labordienstleistungen. Durch diese Rückmeldungen unserer Einsender und Patienten erhalten wir direkte Einblicke in Ihre Wünsche und Vorstellungen zu unserem Portfolio.
Die Zufriedenheit unserer Einsender und Patienten ist uns wichtig. Aus diesem Grund ist es für uns ein sehr großes Anliegen, dass Beschwerden nachverfolgt und dokumentiert werden. Wir leiten nach gründlicher Beschwerdeuntersuchung und -klärung nicht nur Korrekturmaßnahmen ein, sondern nutzen die Beschwerden auch als Eingaben für den kontinuierlichen Verbesserungsprozess unseres Laboratoriums.
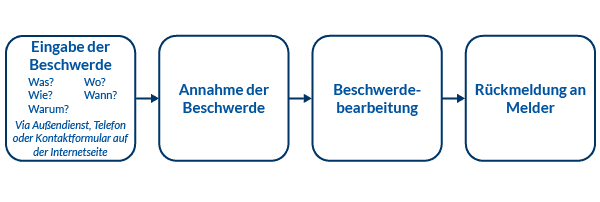
Ihr Anliegen können Sie uns über unser mitteilen.

