Lungenkarzinom, nichtkleinzellig (NSCLC)
Das nicht-kleinzellige Lungenkarzinom (NSCLC) stellt mit etwa 85-90% den größten Anteil der bösartigen Lungenerkrankungen dar, wobei eine frühzeitige Diagnose selten erfolgt und die 5-Jahres-Überlebensrate bei Stadium IV lediglich 2% beträgt. Die Therapiestrategie hat sich von konventionellen Ansätzen zu genetisch geleiteten Therapien entwickelt, wobei EGFR-Varianten, ALK-Umlagerungen und andere genetische Veränderungen mit spezifischen Tyrosinkinaseinhibitoren (TKIs) zielgerichtet behandelt werden können. Resistenz gegenüber diesen Therapien ist eine Herausforderung, die durch fortlaufende Entwicklung neuer Generationen von TKIs und personalisierte Ansätze wie Liquid Biopsy und molekulare Diagnostik adressiert wird. Effektive Inhibitoren und genetische Biomarker haben das Gesamtüberleben signifikant verbessert, und die Bestimmung der PD-L1-Expression sowie Tumormutationslast kann die Wirksamkeit einer Immuntherapie vorhersagen.
Wissenschaftlicher Hintergrund
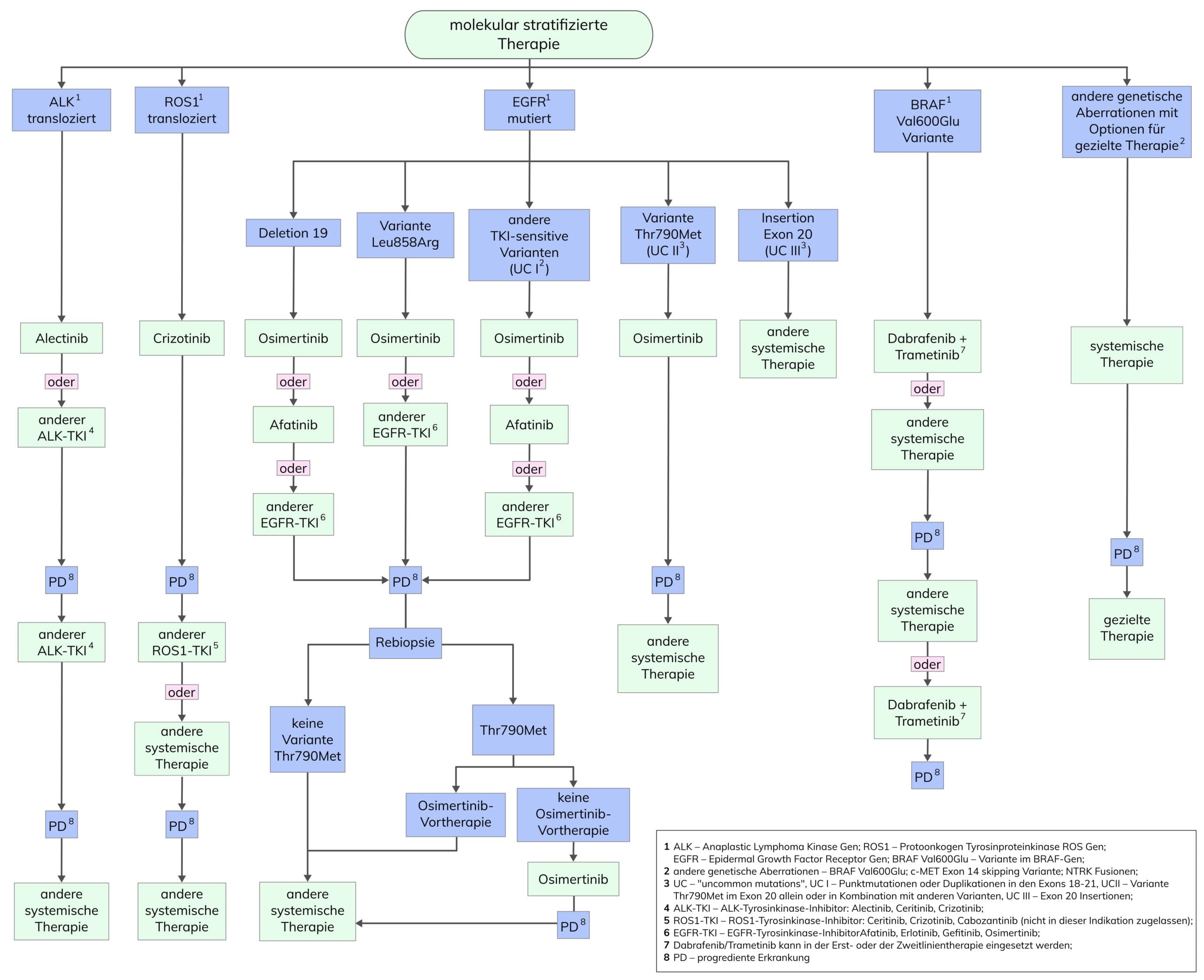
Das Lungenkarzinom ist eine der weltweit am häufigsten zum Tode führende Krebserkrankung und bildet eine heterogene Gruppe an Tumoren mit mehr als 50 histo-morphologischen Untergruppen. Das nicht-kleinzellige Lungenkarzinom (NSCLC) bildet mit etwa 85-90% die größte Gruppe der bösartigen Lungenerkrankungen, wobei Adenokarzinome (ADC) mit 40-50% und Plattenepithelkarzinome (SCC) mit 20-30% die häufigsten histologischen Untergruppen sind. Nur wenige Patienten werden zu einem frühen Zeitpunkt der Erkrankung (Stadium I oder II) diagnostiziert. In über 60% der Fälle findet sich ein lokal fortgeschrittenes oder metastasiertes Karzinom (Stadium III oder IV), bei dem eine Resektion nicht mehr möglich ist. Die 5-Jahres-Überlebensrate liegt für alle Stadien im Mittel bei ca. 17%, bei NSCLC im Stadium IV hingegen nur noch bei 2% und darunter. Die Entwicklung zielgerichteter Therapien hat die Therapiestrategie von der konventionellen Chemo- und Strahlentherapie zur genetisch geleiteten Therapie weiterentwickelt. Daher sollte bei allen Stadium IV-Patienten vor Beginn einer medikamentösen Erstlinientherapie eine Erhebung Therapie-relevanter Varianten erfolgen.
Aktivierende Varianten im EGFR-Gen, die in 10-12% der Kaukasier mit NSCLC gefunden werden und häufiger bei Nichtrauchern, Frauen und auch bei Patienten mit ostasiatischer Ethnizität vorkommen, waren die erste molekulare Läsion, die zielgerichtet therapiert werden konnten. EGFR-Varianten finden sich in ca. 30% der ADC und selten bei SCC. Mittlerweile stehen eine Reihe von EGFR-Tyrosinkinaseinhibitoren (EGFR-TKI) zur Verfügung, deren Wirksamkeit vom TKI selbst und der Art der EGFR-Variante abhängt. Die häufigsten EGFR-Varianten sind Deletionen in Exon 19 (Del19) und die Exon 21 Leu858Arg-Variante (85-90%). Weitere Varianten finden sich vorrangig in Exon 18 und 20. Bei einem Großteil der Patienten kommt es im Verlauf der zielgerichteten Behandlung aufgrund von primär und sekundär erworbenen Resistenzmechanismen gegenüber zielgerichteten Wirkstoffen zu einer Progression der Erkrankung. Bei Patienten mit aktivierender EGFR-Variante, die mit EGFR-TKI der ersten und zweiten Generation behandelt werden, ist die häufigste Resistenzursache (49-60%) das Auftreten der Thr790Met-Missense-Variante in Exon 20 von EGFR. Dieser Umstand hat zu der Entwicklung von Nachfolge-TKIs geführt, die z.B. als Dritt-Generationen-TKIs sowohl die aktivierende als auch die Resistenzvariante Thr790Met therapeutisch abdecken. Teilweise ist diese Resistenzvariante auch bereits bei Diagnosestellung im Primärtumor nachweisbar. Bei Progress unter TKI und Verdacht auf Resistenz sollte der Nachweis der Thr790Met-Variante an einer Gewebe-Rebiopsie erfolgen. Dieses Material ermöglicht die Untersuchung auch der anderen Resistenzen, die bei EGFR positiven NSCLC vorkommen (z.B. Cys797Ser). Bei Nichtverfügbarkeit einer Gewebebiopsie ist jedoch auch die Liquid Biopsy zur gezielten Suche nach Thr790Met unter Angabe der aktivierenden EGFR-Variante ein geeignetes Verfahren.
Bei der wird an zellfreier Tumor-DNA (ctDNA) im Blutplasma nach therapeutisch relevanten Varianten gesucht. Dies kann gezielt (z.B. Thr790Met) oder unter Verwendung eines Genpanels erfolgen. Dieses ist vor allem bei fortgeschrittenen Tumorstadien eine geeignete Alternative. Mit einem Limit of Detection (LOD) von 0,1% ist diese Analyse sehr sensitiv. Dennoch kann der Anteil der ctDNA bzw. Varianten-Allel-Frequenz (VAF) insbesondere in früheren Tumorstadien darunter liegen und zu falsch-negativen Ergebnisse führen.
ALK-Umlagerungen, hauptsächlich Translokationen, treten bei etwa 3-13% der ADC, eher jüngeren Patienten und Nie-Rauchern und nur in Abwesenheit von EGFR– und KRAS-Varianten auf. Zusätzlich sind hier eher Pleura-, Perikard- und Hirnmetastasen beschrieben. Meist findet sich eine Fusion mit EML4. Für die Behandlung von Patienten mit ALK-Umlagerung stehen ALK-TKIs zur Verfügung. Allerdings können unter Therapie mit ALK-TKI (vor allem Crizotinib) Resistenzvarianten in ALK auftreten oder andere Signalwege z.B. durch das Auftreten aktivierender Varianten in EGFR angeschaltet werden, die bei Progress unter ALK-TKI und Verdacht auf Resistenz an einer Gewebe-Rebiopsie überprüft werden sollten.
ROS1-Umlagerungen finden sich in etwa 1-2% der NSCLC, schließen ALK-, EGFR- und KRAS-Veränderungen aus und qualifizieren Patienten für eine Therapie mit Crizotinib. Lorlatinib und Carbozantinib sind Zweitgenerations-TKIs für ROS1-positive Patienten, die eine Resistenz gegenüber Crizotinib entwickelt haben.
Varianten in BRAF, vorrangig an Aminosäureposition Val600, finden sich in ca. 6% der ADC und 4% der SCC, welche mit einer Kombinationstherapie aus Dabrafenib und Trametinib behandelt werden können.
Es gibt zahlreiche weitere Veränderungen, für die spezifische Therapiekonzepte geprüft werden und wirksame Inhibitoren in klinische Studien zur Verfügung stehen: HER2-Amplifikationen, KRAS-Varianten, MET-Veränderungen, NRG-Fusionen, NTRK-Fusionen und RET-Translokationen.
In verschiedenen Studien konnte gezeigt werden, dass Patienten mit diesen genetischen Veränderungen, die einer gezielten Therapie zugeführt werden konnten, eine signifikante Verbesserung des Gesamtüberlebens (OS) im Vergleich zu denjenigen Patienten hatten, bei denen keine geeigneten Biomarker nachweisbar und die keiner zielgerichteten Behandlung zugänglich waren.
Bei Patienten ohne genetische Veränderungen, für die zielgerichtete Therapien zugelassen sind, gilt die Empfehlung der Bestimmung der PD-L1-Expression für eine mögliche Immuntherapie mit Checkpoint-Inhibitoren. Die Bestimmung der bei Patienten mit NSCLC kann als prädiktiver Biomarker die Auswahl von Patienten unterstützen, die von einer Immun-Checkpoint-Inhibitor-Therapie profitieren können, und wurde bereits in den National Comprehensive Cancer Network (NCCN) Leitlinien für eine Immuntherapie mit Checkpoint-Inhibitoren (Nivolumab mit oder ohne Ipilimumab) als Erstlinientherapie bei metastasierendem NSCLC mit hoher TMB empfohlen.
Die Diagnose des Lungenkarzinoms erfolgt grundsätzlich morphologisch, üblicherweise an kleinen Biopsien. Nach Entitätsbestimmung durch den Pathologen müssen an diesem meist begrenzten Material alle Untersuchungen zur Bestimmung der Therapie-relevanten Biomarker durchgeführt werden. Daher sind diagnostische Ansätze, die eine gleichzeitige Bestimmung aller relevanten Varianten, der TMB und der Mikrosatelliteninstabilität ermöglichen, die Untersuchungsmethode der Wahl. Diese Untersuchungen können genauso wie gezielte Sequenzanalysen einzelner Gene am fixierten Tumormaterial (FFPE) durchgeführt werden.