Lecanemab-Therapie (APOE)
Alzheimer ist die häufigste Demenzform und geht mit β-Amyloid-Ablagerungen im Gehirn einher. Lecanemab (Leqembi®) ist ein humanisierter IgG1-Antikörper, der Aβ-Protofibrillen/Oligomere bindet, Plaqueneubildung hemmt und bestehende Ablagerungen reduziert und dadurch das Fortschreiten der Erkrankung verlangsamen kann. Vor Einsatz ist die APOE-ε4-Genotypisierung obligat, da homozygote Träger ein deutlich erhöhtes Risiko für amyloid-assoziierte Bildgebungsanomalien (ARIA) aufweisen.
Wissenschaftlicher Hintergrund
Alzheimer ist die häufigste Form der Demenz und betrifft weltweit über 55 Millionen Menschen. Sie äußert sich vor allem durch fortschreitenden Gedächtnisverlust, kognitive Einschränkungen und den Verlust alltäglicher Fähigkeiten. Die Krankheit entsteht durch komplexe biologische Prozesse. Im Mittelpunkt steht die Anhäufung fehlgefalteter Proteine im Gehirn. Lecanemab, vertrieben unter dem Handelsnamen Leqembi®, ist ein humanisierter monoklonaler IgG1-Antikörper, der gezielt gegen die besonders neurotoxischen Protofibrillen und Oligomere des Beta-Amyloid (Aβ) gerichtet ist und in Deutschland seit dem 01.09.2025 zugelassen wurde. Dieser duale Wirkmechanismus verhindert die Bildung neuer Plaques und entfernt gleichzeitig vorhandene amyloide Ablagerungen, welche die Signalübertragung zwischen Nervenzellen stören und chronische Entzündungsreaktionen auslösen.
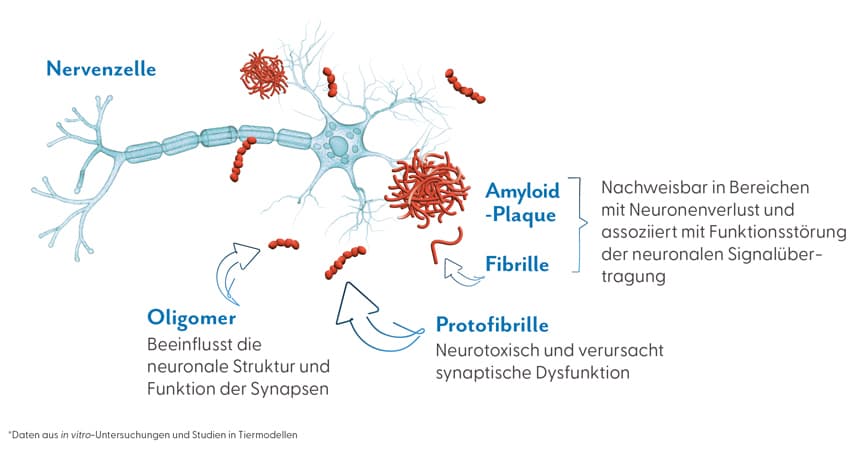
In der Phase‑III-Studie „CLARITY AD“ mit 1.795 Patient:innen im Frühstadium der Alzheimer‑Demenz reduzierte Lecanemab den kognitiven Abbau um ca. 27 % nach 18 Monaten im Vergleich zu Placebo. Der CDR‑SB-Score (Clinical Dementia Rating – Sum of Boxes) verschlechterte sich im Mittel um 1,21 Punkte (Lecanemab) gegenüber 1,66 Punkten (Placebo). Langzeitdaten (über insgesamt 48 Monate) deuten darauf hin, dass die Behandlung mit Lecanemab das Fortschreiten der Erkrankung verlangsamt und etwa 10,8 zusätzliche Monate im frühen Krankheitsstadium bedeuten kann.
Vor Beginn einer Lecanemab-Therapie ist in Deutschland eine Genotypisierung auf APOE ε4 vorgeschrieben, da Träger von zwei Kopien dieses Gens (homozygot) ein deutlich erhöhtes Risiko für amyloid-assoziierte Bildgebungsanomalien (ARIA) wie Hirnschwellungen (ARIA-E) und Hirnblutungen (ARIA-H) aufweisen. Nur Patient:innen ohne APOE ε4 oder mit einer Kopie (Heterozygotie) profitieren, ohne ein unvertretbares Risiko einzugehen. Daher ist die genetische Analyse ein essentieller Sicherheitsbaustein. Zudem empfiehlt sich bei heterozygoten APOE ε4‑Trägern eine engmaschigere Überwachung (z. B. via MRT) im ersten Behandlungsjahr. Medicover Diagnostics bietet hierzu die notwendige Genotypisierung, sodass gezielt jene Patient:innen identifiziert werden können, die für eine Leqembi-Therapie geeignet sind.
* Aufgrund laufender Aktualisierungen können die hier aufgeführten Gene vorübergehend vom derzeit aktuellen Portfolio abweichen.
Erkrankung | ICD—10 | Gen | OMIM—G |
| - | - | APOE | 107741 |